4月14日,,國務(wù)院聯(lián)防聯(lián)控機(jī)制新聞發(fā)布會(huì)上,科技部社會(huì)發(fā)展科技司司長(zhǎng)吳遠(yuǎn)彬介紹,,目前已有三個(gè)疫苗獲批進(jìn)入臨床試驗(yàn),。
其中,由國藥集團(tuán)中國生物武漢生物制品研究所研發(fā)的新冠病毒滅活疫苗,,4月12日獲國家藥監(jiān)局批準(zhǔn)開展臨床試驗(yàn),。同日,該疫苗Ⅰ期臨床試驗(yàn)在河南順利啟動(dòng),。臨床試驗(yàn)第一針已在武陟縣疾病預(yù)防控制中心疫苗臨床研究現(xiàn)場(chǎng)完成注射,。
此外還有兩個(gè)獲批開展臨床試驗(yàn)的疫苗是,陳薇院士團(tuán)隊(duì)研發(fā)的重組新冠病毒已于3月底完成Ⅰ期臨床試驗(yàn)受試者的接種工作,,4月9日開始招募Ⅱ期臨床試驗(yàn)志愿者,。北京科興中維生物技術(shù)有限公司研制的滅活疫苗4月13日開展臨床試驗(yàn)。
作為全球首個(gè)新冠病毒滅活疫苗,,國藥集團(tuán)中國生物在河南焦作武陟縣開展的臨床試驗(yàn)備受關(guān)注,。紅星新聞?dòng)浾咴谥袊R床注冊(cè)中心查詢到,該疫苗試驗(yàn)I期/II期合并注冊(cè),,通過隨機(jī),、雙盲、安慰劑平行對(duì)照的方式展開,,試驗(yàn)對(duì)象要求為6歲及以上的健康人群,,要求受試者,從2019年12月至今未去過湖北,、境外及出現(xiàn)過疫情的村/社區(qū),,未接觸新型冠狀病毒感染者或疑似病例,處于非隔離期內(nèi)的人員,,且同村/社區(qū)內(nèi)未出現(xiàn)新型冠狀病毒感染者或疑似病例,。試驗(yàn)的注冊(cè)日期是從2020年4月11日到2021年11月10日。
受試者將分為Ⅰ/Ⅱ期,,各期再分為低劑量組,、中劑量組和高劑量組,各組均設(shè)置安慰劑對(duì)照組,。Ⅰ期試驗(yàn)組每組24人,,對(duì)照組8人;Ⅱ期試驗(yàn)組每組60人,對(duì)照組20人,。試驗(yàn)的主要測(cè)量指標(biāo)是每劑接種后的不良反應(yīng)的發(fā)生率,次要指標(biāo)包括抗新型冠狀病毒血清抗體4倍增長(zhǎng)率和抗體水平以及細(xì)胞免疫,。
而中國生物相關(guān)負(fù)責(zé)人告訴紅星新聞,,根據(jù)國家相關(guān)法律法規(guī)規(guī)定,已為應(yīng)急使用做好充分準(zhǔn)備,。中國生物具備大規(guī)模滅活疫苗生產(chǎn)能力,,申報(bào)新冠疫苗臨床試驗(yàn)批次產(chǎn)量超過5萬劑,量產(chǎn)后年產(chǎn)能1億劑以上,。
這次疫苗試驗(yàn)為什么在河南而不在武漢開展,?疫苗試驗(yàn)受試者的年齡范圍如何確定?受試志愿者招募情況怎么樣,?Ⅰ期臨床試驗(yàn)與Ⅱ期臨床試同時(shí)開展嗎,,將在什么時(shí)候結(jié)束?Ⅰ期臨床試驗(yàn)受試者需要注射幾次,?疫苗研發(fā)背后有哪些不為人知的故事,? 4月14日,紅星新聞?dòng)浾擢?dú)家專訪了中國生物副總裁,、科研負(fù)責(zé)人張?jiān)茲?
對(duì)話實(shí)錄:
關(guān)于疫苗臨床試驗(yàn)時(shí)間:
Ⅰ/Ⅱ期臨床試驗(yàn)分步展開,,預(yù)計(jì)今年年底初步做完
紅星新聞:我們看到疫苗試驗(yàn)注冊(cè)截止時(shí)間是到2021年11月10日,從現(xiàn)在起也就是有19個(gè)月的時(shí)間,,而且是Ⅰ/Ⅱ期合并臨床試驗(yàn),。那么Ⅰ期試驗(yàn)和Ⅱ期試驗(yàn)是同時(shí)開展的嗎?
張?jiān)茲耗壳?,?Ⅱ期臨床計(jì)劃采用序貫入組的方式開展,。 我們?cè)冖衿谠囼?yàn)各個(gè)年齡段劑量爬坡觀察到安全性以后,其中有一個(gè)年齡段進(jìn)一步開展Ⅱ期的劑量和程序的探索,。在整個(gè)臨床試驗(yàn)過程的設(shè)計(jì)上還是應(yīng)用了一些設(shè)計(jì)技巧,。試驗(yàn)的分段很清晰。在安全性沒有問題,,以后再進(jìn)行免疫程序和免疫劑量探討,。這是一個(gè)規(guī)范性標(biāo)準(zhǔn)的創(chuàng)新藥品臨床設(shè)計(jì)方案。
紅星新聞:現(xiàn)在預(yù)期Ⅰ/Ⅱ期臨床試驗(yàn)什么時(shí)候做完,?
張?jiān)茲簯?yīng)該是在今年年底能夠初步完成Ⅰ/Ⅱ期臨床研究,。
紅星新聞:Ⅰ/Ⅱ期合并進(jìn)行試驗(yàn)注冊(cè)是一個(gè)緊急狀態(tài)下的特殊方案嗎?
張?jiān)茲翰皇?。?Ⅱ/ Ⅲ期可以一起做注冊(cè),。只是要在不同時(shí)間節(jié)點(diǎn)來開展臨床研究工作。我們的實(shí)際情況是先啟動(dòng)Ⅰ期臨床試驗(yàn),Ⅰ期臨床試驗(yàn)的目標(biāo)就是在一個(gè)年齡段觀察疫苗的安全性沒有問題,。然后再在這個(gè)年齡段進(jìn)行程序,、劑量的Ⅱ期探索,那么其他年齡段還持續(xù)在做Ⅰ期計(jì)量爬坡和安全性的觀察試驗(yàn),。
關(guān)于臨床試驗(yàn)具體內(nèi)容:
Ⅰ期臨床試驗(yàn)受試者最多注射三針,,Ⅱ期試驗(yàn)不會(huì)將受試者放在可能感染的環(huán)境
紅星新聞:現(xiàn)在受試者的招募情況怎么樣?
張?jiān)茲何覀兦疤欤?月12日)第一階段的入組已經(jīng)完成,。
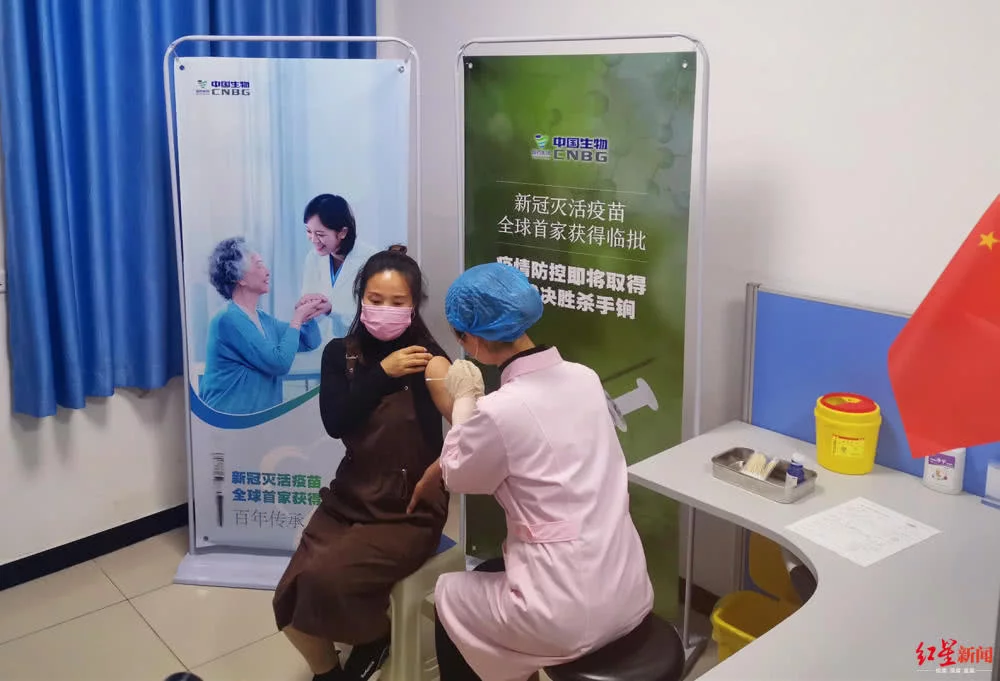
紅星新聞:Ⅰ期試驗(yàn)受試者需要打幾針,?
張?jiān)茲孩衿谂R床試驗(yàn)受試者最多打三針。因?yàn)槲覀円^察的是安全性,,就Ⅰ期的安全性試驗(yàn)是要覆蓋未來可能給藥的最多針次,。
紅星新聞:Ⅰ期臨床試驗(yàn)如果是對(duì)疫苗安全性的觀察,那Ⅱ期臨床試驗(yàn)的作用是什么,?要對(duì)受試者進(jìn)行怎樣的觀察,?
張?jiān)茲孩蚱谂R床其實(shí)就是按規(guī)定要求和創(chuàng)新要求觀察疫苗未來的免疫程序。就是打兩針還是打三針,,間隔多長(zhǎng)時(shí)間打,,還有免疫劑量是多少的問題。免疫劑量就是疫苗中的病毒含量,。我們有高中低三個(gè)劑量,,需要確定未來人群接種使用哪個(gè)劑量。
紅星新聞:Ⅱ期疫苗試驗(yàn)是否需要把注射過疫苗的受試者放在易于感染的環(huán)境中來看保護(hù)效果,?
張?jiān)茲翰皇?。我們現(xiàn)在都是招募身體健康的受試者進(jìn)行Ⅱ期試驗(yàn)。Ⅱ期試驗(yàn)是不會(huì)將受試者放在可能感染的環(huán)境中,,而是在一個(gè)完全正常的環(huán)境中,。對(duì)疫苗的免疫程序和免疫力量的探索,根本不涉及環(huán)境被新冠病毒污染的這樣一個(gè)概念,。完全不會(huì)涉及這些,,這是一個(gè)要點(diǎn)。
關(guān)于臨床試驗(yàn)受試者要求:
臨床試驗(yàn)受試者覆蓋全年齡段與新冠肺炎發(fā)病人群完全吻合
紅星新聞:此前,,陳薇院士團(tuán)隊(duì)研制的重組新型冠狀病毒疫苗進(jìn)行臨床試驗(yàn),,選擇的試驗(yàn)對(duì)象是18周歲及以上的健康成人。而我注意到,,中國生物研制的疫苗的臨床試驗(yàn)將受試者年齡設(shè)置在6歲及以上,。疫苗臨床試驗(yàn)受試者年齡的設(shè)置是出于什么考慮?
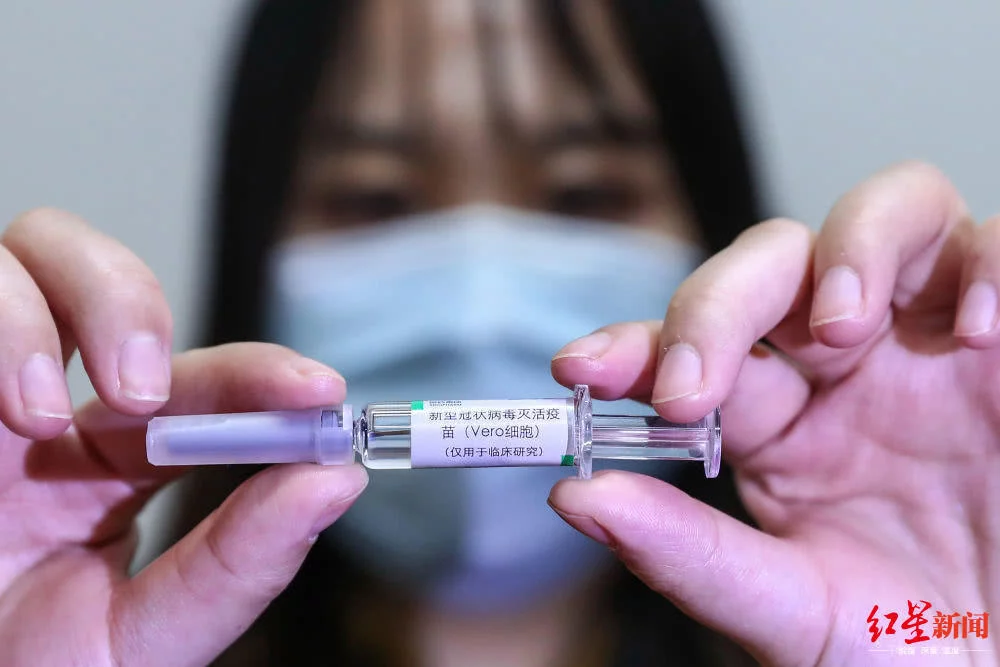
張?jiān)茲焊骷乙呙缟a(chǎn)企業(yè),、醫(yī)療研發(fā)結(jié)構(gòu)的臨床試驗(yàn)根據(jù)疾控中心的審批,,在年齡上的設(shè)置都有自己的考慮和安排,。我們考慮是,新冠病毒引起的新冠肺炎是一個(gè)覆蓋全年齡段的疾病,。未來的也要普及到全年齡段,,保持疫苗的可及性。所以我們從6歲開始到60歲以上都有,,做一個(gè)全年齡段的觀察,。這樣就和新冠肺炎的發(fā)病人群完全吻合。
如何觀察受試者,?
臨床試驗(yàn)受試者居家觀察,但嚴(yán)密隨訪
紅星新聞:我們的受試者現(xiàn)在需不需要像陳薇院士團(tuán)隊(duì)在武漢做的臨床試驗(yàn)一樣,,讓他們住在一起,,做集中的觀察?
張?jiān)茲何覀儧]有做這樣的設(shè)計(jì),。因?yàn)楦鱾€(gè)疫苗的性質(zhì)和特點(diǎn)不一樣,。我們的疫苗的在臨床前安全性的評(píng)價(jià)上用了很多指標(biāo)來測(cè)定,在臨床前做了7種動(dòng)物的免疫保護(hù)研究和安全性觀察,。所以我們沒有讓受試者在一個(gè)賓館或者集中點(diǎn)來觀察,,而是讓受試者回到家,做居家觀察,。當(dāng)然我們會(huì)派人到受試者聚集的地方,,每天主動(dòng)加強(qiáng)隨訪。
疫苗試驗(yàn)為何在河南焦作開展,?
此前河南疾控中心已做了50多種疫苗臨床試驗(yàn),,經(jīng)驗(yàn)豐富
紅星新聞:這次疫苗臨床試驗(yàn)安排在了河南焦作武陟縣,為什么選擇在這里開展試驗(yàn),?疫苗臨床試驗(yàn)地點(diǎn)的選擇要考慮哪些因素,?
張?jiān)茲哼@樣是因?yàn)槲覀兏幽鲜〖部刂行挠卸嗄甑暮献麝P(guān)系,他們是我們的戰(zhàn)略合作伙伴之一,。另外,,河南省疾控中心是近幾年來國內(nèi)承擔(dān)醫(yī)療臨床試驗(yàn)最多的省級(jí)疾控部門,做了50多種疫苗臨床試驗(yàn),。他們的經(jīng)驗(yàn)非常豐富,,做過各類疫苗的臨床試驗(yàn)研究。第三就是河南省交通便利,。還有這次選擇的這個(gè)醫(yī)療點(diǎn)具有GCP資質(zhì)(國家藥物臨床試驗(yàn)機(jī)構(gòu)認(rèn)證資質(zhì)),。按照規(guī)定,一年內(nèi)做過疫苗臨床試驗(yàn)并且有GCP資質(zhì)的醫(yī)療機(jī)構(gòu),,不用再向國家藥品監(jiān)督管理局申請(qǐng)GCP資質(zhì),。綜合這些因素,,我們選擇了在河南焦作武陟開展這一項(xiàng)研究。
關(guān)于疫苗臨床試驗(yàn)背后故事
疫苗研發(fā)經(jīng)歷98個(gè)晝夜 科研團(tuán)隊(duì)按照“戰(zhàn)時(shí)狀態(tài)”管理
紅星新聞:這款滅活疫苗的研制經(jīng)歷了哪些過程,?在臨床試驗(yàn)前經(jīng)過了哪些測(cè)試,?
張文濤:在4月12日拿到疫苗臨床試驗(yàn)批件之前,我們進(jìn)行了98天的晝夜奮戰(zhàn),。經(jīng)過了幾個(gè)階段的工作,。
第一階段就是疫苗毒株的選育和三級(jí)種子庫的建立。在這個(gè)階段我們比較了很多不同來源的毒株,,對(duì)它們的免疫原性做了研究,,也做了深度基因測(cè)序,對(duì)各項(xiàng)指標(biāo)都進(jìn)行了鑒定,。
第二階段,,我們由病毒三級(jí)庫得到病毒以后,在Vero細(xì)胞上做適應(yīng)性培養(yǎng),。從適應(yīng)性培養(yǎng)一直到建立整個(gè)培養(yǎng)工藝,、接種參數(shù)、純化工藝,、配置工藝,,做了系統(tǒng)性研究。
第三階段,,在整個(gè)研制過程中,,因?yàn)檫@一個(gè)是創(chuàng)新性的疫苗,全球都沒有質(zhì)量標(biāo)準(zhǔn)和參考依據(jù),。所以我們制定了我們疫苗的很多指控的標(biāo)準(zhǔn),,比如抗體檢測(cè)方法、抗原檢測(cè)方法,、殘留DNA檢測(cè),、殘留細(xì)胞蛋白檢測(cè)方法等等一系列檢測(cè)方法。還有建立了針對(duì)藥典上沒有的一些特異的冠狀病毒疫苗研發(fā)的解決方法和質(zhì)量標(biāo)準(zhǔn),。

第四步,,在完成這些制劑配方和標(biāo)準(zhǔn)建立之后,我們開展了動(dòng)物的安全性評(píng)價(jià)和攻毒保護(hù)試驗(yàn),。安全性評(píng)價(jià)我們?cè)诜侨遂`長(zhǎng)類,、鼠類分別做了過敏、急毒,、長(zhǎng)毒的觀測(cè),,同時(shí)也在非人靈長(zhǎng)類和鼠類體內(nèi)做了主動(dòng)攻毒保護(hù)和被動(dòng)攻毒保護(hù)等一系列試驗(yàn)。這些試驗(yàn)第一證明疫苗是安全的,,第二證明疫苗是有效的,。有效性就是通過動(dòng)物的攻毒保護(hù)試驗(yàn),,證明疫苗能夠使動(dòng)物體內(nèi)的病毒載量下降,不發(fā)病,。
第五個(gè)階段,,我們申報(bào)了臨床研究。獲得批件以后,,未來大概兩三年的時(shí)間都要開展疫苗的臨床研究,,這是作為第五階段的工作未來要做。
紅星新聞:在臨床前研究一共用了98天的時(shí)間,。能夠在較短的時(shí)間內(nèi)研制出疫苗,,是否與我們過去一些技術(shù)上的積淀有關(guān)?
張?jiān)茲旱谝?,我們是中國最大的疫苗生產(chǎn)企業(yè),,我們生產(chǎn)了中國80%的兒童一生下來要打的免疫規(guī)劃(EPI)疫苗,還有生產(chǎn)了很多二類疫苗品種,我們有一百年的疫苗研制的歷史,,積累了疫苗研發(fā)生產(chǎn)的經(jīng)驗(yàn)。
這次我們審批的是滅活疫苗技術(shù)路線,。我們?cè)诮鼛啄暧腥蚴装l(fā)的EV71疫苗上市,,也有小兒麻痹的Ipv疫苗上市。過去我們還有滅活的森腦疫苗,、滅活的出血熱疫苗,、滅活的狂犬疫苗、滅活的乙腦疫苗,。這是在一個(gè)平臺(tái)輻射的技術(shù),,積累了豐富的滅活疫苗研發(fā)的經(jīng)驗(yàn)。
第二我們?cè)谶@個(gè)平臺(tái)之上,,我們的很多原輔料,,包括細(xì)胞株,都是用以上市品種的一些原輔料,。這樣會(huì)大幅度會(huì)縮短整個(gè)研究工期,。
第三個(gè)方面,我們?cè)谝患?jí)種子庫建立同時(shí)把還把很多“串聯(lián)”的工作,,全部變成了“并聯(lián)”的工作,。這樣來做整個(gè)工作就大幅度提速。另外在新冠疫情期間,,我們也以“戰(zhàn)時(shí)狀態(tài)”來管理科研團(tuán)隊(duì),,要求整個(gè)研發(fā)團(tuán)隊(duì)晝夜奮戰(zhàn)。
第四個(gè)方面,,就是國家藥監(jiān)局啟動(dòng)了一系列特殊審批機(jī)制,。比如說,,我們研發(fā)要同步滾動(dòng)提交資料,就建立了實(shí)時(shí)提交,,嚴(yán)格同步審批的機(jī)制,。資料在研發(fā)當(dāng)中,不斷審批,。同時(shí)還召開了很多專場(chǎng)技術(shù)會(huì)議,,比如臨床的、藥學(xué)的,、毒理的專場(chǎng)溝通會(huì),。把疫苗獲得批件時(shí)很多藥監(jiān)部門關(guān)注的問題,解決在了整個(gè)研發(fā)的過程之中,。這樣的話時(shí)間就大幅度縮短,。
關(guān)于基因工程疫苗研制進(jìn)度
基因工程疫苗研制按預(yù)計(jì)進(jìn)度開展,已進(jìn)行動(dòng)物試驗(yàn)
紅星新聞:我了解到中國生物還有一條基因工程疫苗的技術(shù)路線,,現(xiàn)在進(jìn)展如何,?
(據(jù)“國資小新”公眾號(hào)消息,1月19日中國生物成立了由科技部“863”計(jì)劃疫苗項(xiàng)目首席科學(xué)家楊曉明掛帥的科研攻關(guān)領(lǐng)導(dǎo)小組,,安排了10億元研發(fā)資金,,布局三個(gè)研究所,集中力量,,在兩條技術(shù)路線上開發(fā)新冠病毒疫苗,。一條技術(shù)路線是滅活疫苗,由武漢生物制品研究所與中國科學(xué)院武漢病毒研究所在武漢協(xié)同攻關(guān),、密切合作開展研發(fā),,國藥集團(tuán)中國生物北京生物制品研究所與中國疾病預(yù)防控制中心病毒病預(yù)防控制所以及中國食品藥品檢定研究院共同奮戰(zhàn)、高效協(xié)作,,在北京研發(fā),;一條技術(shù)路線是基因工程疫苗,由中國生物技術(shù)研究院牽頭推進(jìn),。)
張?jiān)茲夯蚬こ桃呙缫苍诎凑疹A(yù)期進(jìn)展,。目前已經(jīng)開展動(dòng)物評(píng)價(jià)工作,。
紅星新聞:也會(huì)很快就開展臨床試驗(yàn)嗎,?
張?jiān)茲哼@要看疫情的情況,還有國家審評(píng)審批政策是否會(huì)發(fā)生變化,。因?yàn)槲磥砣绻鹿谝呙邕M(jìn)入臨床的多的時(shí)候,,或許很多審批政策就會(huì)做調(diào)整。
紅星新聞:我們現(xiàn)在使用的這些做疫苗的技術(shù)和非典時(shí)期有沒有什么不同,?疫苗研制的條件有哪些不同,?
張?jiān)茲嚎傮w的工藝路線是相同的,,都是滅活疫苗,但是經(jīng)過近年來的發(fā)展,,很多技術(shù)有了進(jìn)步,。比如說當(dāng)年沒有生物測(cè)序,當(dāng)年我們一些指控標(biāo)準(zhǔn)還不夠跟國際接軌,。期間,,由于我們國家研制EV71手足口病疫苗上市,還有我們國家建立了國際上第一個(gè)手足口病疫苗標(biāo)準(zhǔn)品,。我們對(duì)這方面認(rèn)知在大幅度提升,。近十幾年來有很多新的技術(shù)手段,比如結(jié)構(gòu)分析的手段等應(yīng)用到現(xiàn)在的新冠病毒疫苗研發(fā)里面,。應(yīng)該講滅活疫苗是個(gè)傳統(tǒng)到現(xiàn)代,,經(jīng)典而時(shí)尚的一個(gè)技術(shù)。
我們把十幾年來生物技術(shù)高速發(fā)展的一些成果運(yùn)用進(jìn)了現(xiàn)在的疫苗制作中?,F(xiàn)在國家的審批理念也不斷與國際接軌,。很多檢測(cè)手段也不斷更新,都在疫苗里做了體現(xiàn),。
(編輯:鳴嫡)







 “護(hù)眼臺(tái)燈”亂象調(diào)查
“護(hù)眼臺(tái)燈”亂象調(diào)查 AI賬號(hào)成起號(hào)新套路 多手段繞過“AI打標(biāo)”背后有哪些隱患?
AI賬號(hào)成起號(hào)新套路 多手段繞過“AI打標(biāo)”背后有哪些隱患? 救命的醫(yī)療設(shè)備,如何淪為個(gè)人提款機(jī),?
救命的醫(yī)療設(shè)備,如何淪為個(gè)人提款機(jī),? 原價(jià)上千元“貴婦霜”網(wǎng)店賣不到百元
原價(jià)上千元“貴婦霜”網(wǎng)店賣不到百元